Plateau Imagerie Cellulaire
Le plateau technique d’imagerie cellulaire de l’Institut Toulousain des Maladies Infectieuses et Inflammatoires de Purpan offre un large choix de techniques disponibles dans le domaine de la biophotonique pour visualiser des évènements biologiques de l’échelle nanométrique jusqu’à l’échelle de l’organe.
L’accès aux équipements est ouvert aux équipes de recherches publiques internes ou extérieures a INFINITy ainsi qu’aux entreprises privées.
Dans le cadre de son rattachement à la Plateforme technologique des sciences du vivant Toulouse Réseau Imagerie (TRI) et à l’infrastructure nationale France BioImaging (FBI), le plateau d’imagerie d’INFINITy est certifié ISO9001 version 2015 et NF X 50-900 version 2016 afin d’assurer une amélioration continue et la satisfaction de ses utilisateurs.
L'équipe
Actualités
Formations
Le plateau organise régulièrement des formations à destination des partenaires publics et privés.
- Formation permanente Inserm:
- Analyse d’images 3D avec le logiciel Imaris: Du 3 au 5 mars 2026 à la salle informatique de la délégation Inserm de Toulouse. Intervenants: Sophie Allart et Sébastien Marais (BIC, Bordeaux).
- Formation QuPath: Des bases aux méthodes avancées pour l’analyse de larges images 2D: Du 10 au 12 juin 2026 à la délégation Inserm de Toulouse. Intervenants: Remy Flores Flores (I2MC, Toulouse), Simon Lachambre et Lhorane Lobjois
- CNRS Formation Entreprise:
- Formation QuPath: Des bases aux méthodes avancées pour l’analyse de larges images 2D: Du 26 au 27 mars 2026 à Toulouse. Intervenants: Simon Lachambre et Lhorane Lobjois
- Analyse d’images 3D avec le logiciel Imaris: Du 28 au 30 avril 2026 à Bordeaux. Intervenants: Sophie Allart et Sébastien Marais (BIC, Bordeaux)
- Ecole doctorale:
- Formation QuPath: Des bases aux méthodes avancées pour l’analyse de larges images 2D: Du 16 au 17 mars 2026 à Toulouse. Intervenant: Remy Flores Flores (I2MC, Toulouse), Simon Lachambre et Brice Ronsin (CBI, Toulouse)
- Atelier Technologique:
- Les bases du Python pour l’analyse d’images de microscopie. Du 18 au 21 mai 2026 à Toulouse. Intervenants: Erwan Grandgirard (IGBMC, Strasbourg), Lhorane Lobjois, Jerome Mutterer (IBMP, Strasbourg)
Inscription sur Sirène ou pour les non INSERM par mail à cindy.neves@inserm.fr
Prestations de service
Pour tout nouvel utilisateur, un entretien préalable permet de mettre en place le protocole de préparation des échantillons et de planifier la réalisation de votre expérience. Dans le cadre de ses activités, le plateau offre deux types de prestations :
- La mise en autonomie : après une formation sur l’équipement adapté, l’utilisateur est autonome et peut réserver lui-même des créneaux pour l’utilisation du microscope.
- Réalisation- expertise : Le personnel du plateau vous accompagne dans la mise au point et le développement de projets de recherche sous forme de collaborations adossées à vos projets scientifiques.
Formation, conseil, expertise
- Formation à l’utilisation des appareils
- Aide à la mise en place ou l’optimisation d’un protocole expérimental
- Assistance à l’utilisation de certaines techniques
- Aide à l’analyse d’images
- Expertises pour les laboratoires privés
- Formation continue (INSERM, CNRS, Université, Entreprises privées, Workshop)
Applications
Techniques disponibles sur le plateau
- Imagerie multiplex « one-shot »
- Imagerie spectrale
- Imagerie cellulaire dynamique
- FRET
- TIRF
- FRAP/ FLIP/ iFRAP
- IRM (Interference Reflection Microscopy)
- Biphoton
- STED
- Photoactivation
- uPAINT
Analyses d’images
- Quantification d’objets
- Quantification d’intensité de fluorescence
- Colocalisation
- Automatisation des taches par macro commandes
- Analyse 4D grâce à Imaris
- ImageJ
- QuPath
- Formation à l’analyse d’images
Équipements
Le plateau technique d’Infinity vous propose des outils pour imager vos échantillons de l’échelle cellulaire à l’échelle tissulaire.
Microscope confocal Leica SP8- STED 3X
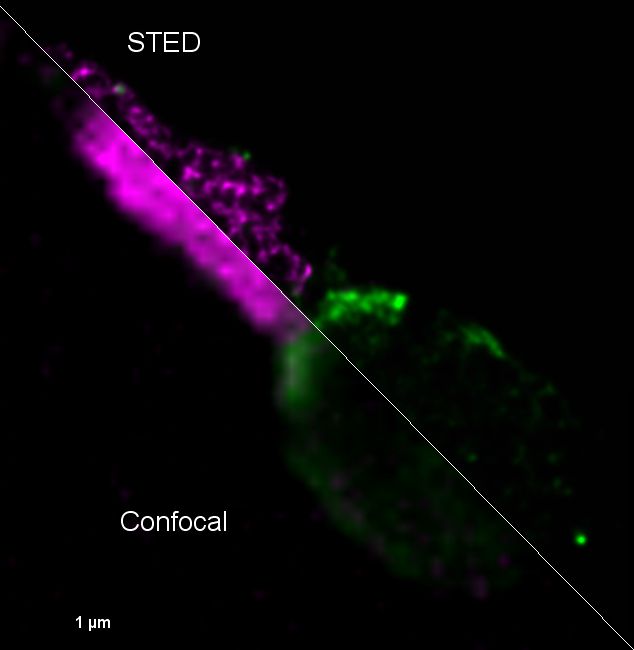
Mise en évidence du virus Zika dans les spermatozoïdes humains par microscopie de super-résolution STED. Tom20-StarRed (Mitochondries en vert) et 4G2-Alexa-594 (Virus Zika en violet). Elsa Suberbielle, équipe Dunia, CPTP.
Equipé d’une diode UV (405nm) et de 4 diodes dans le visible (488 nm, 532 nm, 552nm et 635 nm), sur statif inversé motorisé.
- Pour le STED, les lasers d’excitation disponibles sont les 532 et 635 nm. Le laser de dépletion est le 775nm.
- Les objectifs présents sont un 10x Plan Fluotar (ouverture numérique: 0.3), un 20x Plan Fluotar DIC (ouverture numérique: 0.8), un 40x Plan APO (ouverture numérique: 1.3) à immersion à huile, un 63x plan APO DIC (ouverture numérique: 1.4) à immersion à huile ainsi qu’un 100x (ouverture numérique: 1.4) utilisable uniquement pour les expériences de STED.
- Le système est équipé de 3 hybrides détecteurs de très haute sensibilité (avec un rendement quantique de 45% contre 25% pour des PMTs classiques) ainsi que deux photomultiplicateurs.
- La possibilité de thermorégulation de la préparation permet l’acquisition d’échantillons vivants au cours du temps.
- Attention: la thermorégulation se fait grâce à la Brick d’Ibidi qui nécessite l’utilisation de supports Ibidi.
Microscope confocal Zeiss LSM 710
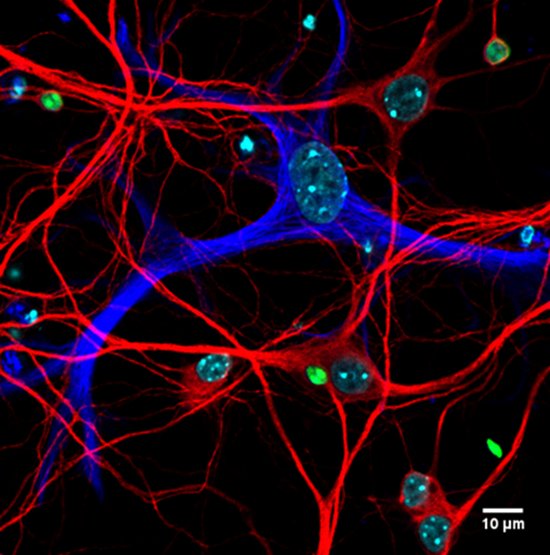
A mouse hippocampal neuronal culture infected by Toxoplasma gondii tachyzoïtes (Red: MAP2, Blue: GFAP, Green: T. gondii), Marcy Belloy, Equipe Blanchard
- Equipé d’une diode UV (405nm) et de 3 lasers dans le visible (un laser argon multi-raies à 458 nm, 488 nm, et 514 nm, d’un DPSS à 561 nm et d’un HeNe 633 nm), sur statif inversé motorisé.
- Les objectifs présents sont un 20x plan APO (ouverture numérique: 0.8), un 40x plan APO (ouverture numérique: 1.3) à immersion à huile et un 63x plan APO (ouverture numérique 1.4) à immersion à huile.
- La possibilité de thermorégulation de la préparation permet l’acquisition d’échantillons vivants au cours du temps.
- L’analyse spectrale permet de soustraire l’autofluorescence, ou de séparer des fluorochromes dont les spectres d’excitation et d’émission se recouvrent.
- Des modules de FRAP et de colocalisation sont également disponibles.
Microscope MICA
 Microscope champ large inversé automatisé et entièrement motorisé pour la fluorescence et l’histochimie. Adapté pour des acquisitions de mosaïques en 2D ou en 3D.
Microscope champ large inversé automatisé et entièrement motorisé pour la fluorescence et l’histochimie. Adapté pour des acquisitions de mosaïques en 2D ou en 3D.
4 diodes (365nm, 470nm, 555nm, 625nm) pour une acquisition de 4 fluorochromes simultanés grâce à 4 capteurs sCMOS.
Objectifs: 1.5X, 10X, 20X, 63X auto immersion à eau.
Possibilité de faire de la déconvolution « on the fly » en 2D et en 3D.
Inserts: 1 lame, 4 lames, plaques.
Microscope confocal Spinning Disk- TIRF- FRAP
- Equipé de deux lasers dans l’UV à 375 nm et 405 nm et de 3 lasers dans le visible : 491, 561 et 642 nm sur statif inversé.
- Les objectifs présents sont un 10x plan APO (ON 0.75) pour l’observation de plaques, un 20x plan APO (ON 0.75), un 40x à immersion à huile fluor (ON 1.3) pour les expériences nécessitant le laser 375nm, un 60x plan APO à immersion à huile (ON 1.4) et un objectif 100x APO à immersion à huile (ON 1.49) pour les expériences de TIRF. Tous ces objectifs sont équipés pour le DIC.
La tête confocale CSU-X1 permet l’acquisition ultra rapide des images en limitant le photo-bleaching. - Le module iLas² permet de faire des expériences de FRAP/FLIP/Photoactivation ainsi que du TIRF azimutal et du PALM.
- Le microscope est complètement encagé et régulé en CO2 pour le maintien des cellules en conditions environnementales optimales.
Microscope Apotome 2
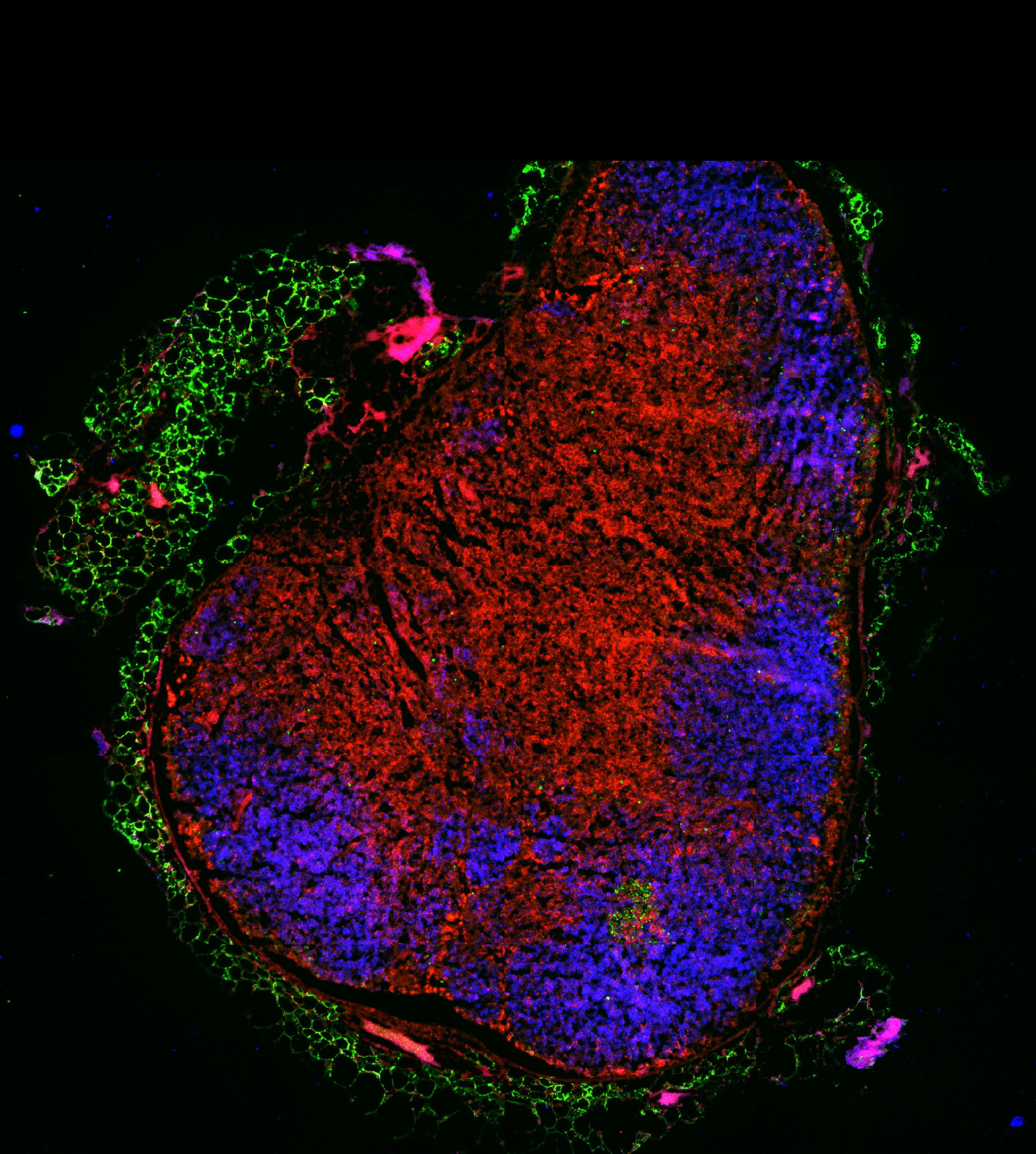
Meryem Aloulou, Equipe Nicolas Fazilleau
- Ce microscope peut être utilisé comme un champ large mais il permet aussi de faire des sections optiques et ainsi d’éliminer la fluorescence hors focus.
- Grâce à ce système il est possible de faire de grandes mosaïques avec un positionnement et un affichage parfait des différentes tuiles.
- Il est aussi possible de retrouver les positions exactes de différents points (exemple: plaque 96 puits) sur plusieurs jours ce qui permet de faire un suivi au cours du temps de l’évolution d’une expérience.
- Enfin, ce microscope peut être utilisé pour l’étude d’évènements dynamiques, jusqu’à une vitesse d’acquisition d’une image par seconde (exemple: étude de flux calcique).
- Le statif inversé comprend des objectifs 10x (ON: 0.45), 20x (ON: 0.8), 40x (ON: 1.4) et 63x (ON: 1.4) et des cubes pour imager le Dapi, vert (GFP, FITC, Alexa 488….), rouge (Cy3, DsRed…) et rouge lointain (Cy5, …) et utilise une HXP 120 comme source d’illumination. Il est aussi équipé d’une caméra haute résolution.
Microscope bi-photon BRUKER 2P PLUS droit
- Microscope multi-photon Bruker 2P Plus, permettant l’observation cellulaire et tissulaire en multicouleur, grâce à ses 4 NDD en réflexion sur statif droit motorisé. Le LASER pulsé femto-seconde Chameleon Discovery est accordable de 680 à 1340 nm.
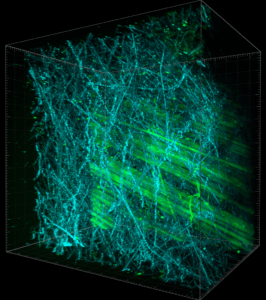
Peau de souris UBI-GFP. Fibre de collagène en SHG (Bleu) et fibroblaste en GFP (Vert). Lhorane Lobjois et Claire Murat
- L’objectif présent est un 20X plongeant plan apo (ON : 1) Olympus.
- Le microscope est équipé d’un scanner Galvo pour les acquisitions classiques et d’un scanner résonnant pour les acquisitions rapides en vivant. Un moteur Z piezo électrique de 400µm permet l’acquisition rapide de l’épaisseur des tissus.
- Il est équipé pour l’explantation tissulaire durant plusieurs heures (oxygénation et thermorégulation), et pour la microscopie chez le petit animal.
Microscope bi-photon ZEISS LSM 7 MP droit
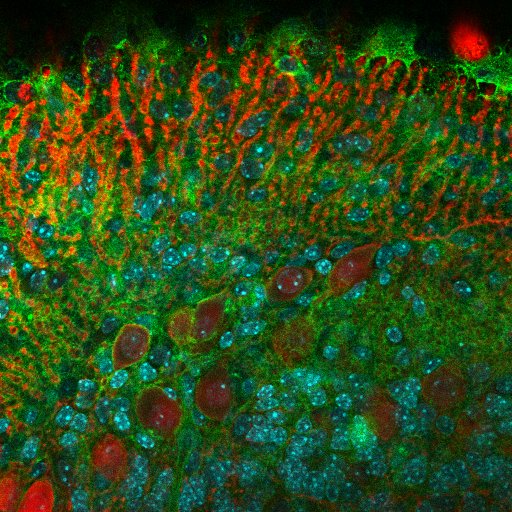
Les cellules de Purkinje sont marquées avec de la calbidin (rouge), les noyaux avec du Dapi (cyan) et le complexe majeur d’histocompatibilité de type I en vert – Lidia Yshii, Equipe Roland Liblau
Microscope multiphoton ZEISS LSM 7 MP droit, permettant l’observation cellulaire et tissulaire en multicouleur, grâce à ses 5 NDD en réflexion sur statif droit motorisé. Le LASER pulsé femtoseconde Chaméléon ultra II est accordable de 690 à 1080 nm.
- Les objectifs présents sont un 20X plongeant plan apo (ON: 1), un 40X plan apo à immersion à huile (ON: 1.4) et un 40X à immersion à eau (ON: 1,1).
- Le microscope est complètement encagé et régulé en CO2 pour le maintient des cellules en conditions environnementales optimales.
- Il est équipé pour l’explantation tissulaire durant plusieurs heures (oxygénation et thermorégulation), et pour la microscopie chez le petit animal.
Traitement & analyse des images
Le plateau d’imagerie met à disposition pour l’analyse 2 postes de travail pour le traitement et l’analyse d’images. Ils sont également utilisés pour déconvoluer les images issues du champ large en utilisant des techniques de calcul distribué. A la demande, les ingénieurs du plateau écrivent des séquences d’automatisation sous ImageJ ou QuPath (macros) afin d’automatiser l’analyse d’images. Des formations sont régulièrement organisées afin de favoriser la prise en main des principaux logiciels d’imagerie.
Les logiciels mis à disposition sont :
-
-
- QuPath: Logiciel gratuit d’analyse de larges images 2D. Segmentation et classification avec des modules d’intelligence artificiel intégrés. Automatisation via des scripts
- ImageJ: logiciel gratuit d’analyse d’images 2D et 3D. Il permet la création d’automatisation de tâches pour les processus répétitifs.
- Imaris: Logiciel de traitement et d’analyse de piles d’images 3D. Il permet la modélisation de surfaces, la détection de spots et leur suivi au cours du temps (tracking), la reconstruction de prolongements cellulaires (dendrites et épines par exemple), l’ensemble associé à des données statistiques. Il permet également de créer des animations pour les présentation et supportent les principaux formats de fichiers issus de la microscopie.
- Zen Light et LSM Browser (Zeiss): pour la visualisation des images acquises avec les microscopes Zeiss (fichiers .lsm et .czi).
- LAS X Leica Lite: pour la visualisation des images acquises avec le microscope Leica SP8 (fichiers .lif).
-
Autres informations
Formulaire de demande, contrat d'utilisation...
Formulaires à remplir pour les nouveaux utilisateurs :
Le comité de pilotage
- Dr L. Dupré (Infinity-Eq Lesourne/Dupré) – Animation Scientifique
- Dr D. Dunia (Infinity-Eq Dunia/Malnou) – Animation Scientifique
- Dr S. Guerder (Infinity- Eq Fazilleau/Guerder)
- Dr N. Blanchard (Infinity-Eq Blanchard)
- Dr M. Savignac (Infinity-Eq. Guery)
- Dr M. Diaz-Munoz (Infinity-Eq Diaz-Munoz)
- Dr F. Briand –Messange (Infinity-Eq. Poupot/Ausseil)
- Dr M. Requena (Infinity-Eq Izopet)
- Dr N. Gaudenzio (Infinity-Eq Gaudenzio)
- Dr N. Jabrane-Ferrat (Infinity-Eq Jabrane-Ferrat)
- Dr A. Astier (Infinity-Eq Liblau/Saoudi)
- Dr J. Kamphuis (Infinity-Eq Reber)
- Dr O. Joffre (Infinity-Eq van Meerwijk/Joffre)
- Dr C. Leprince (Infinity-Eq Simon)
- Dr C. Bonnard (IRSD)
Publications
2026 |
Investigating Dysregulated X Chromosome Inactivation in Human B Cells and Plasmacytoid Dendritic Cells by RNA FISH Article de journal Dans: Methods Mol Biol, vol. 2990, p. 157–177, 2026, ISSN: 1940-6029. |
2022 |
Identification of bacterial lipopeptides as key players in IBS Article de journal Dans: Gut, 2022. |
Ca(v)1.4 calcium channels control cytokine production by human peripheral T(H)17 cells and psoriatic skin-infiltrating T cells Article de journal Dans: J Allergy Clin Immunol, vol. 149, no. 4, p. 1348-1357, 2022, ISSN: 1097-6825 (Electronic) 0091-6749 (Linking). |
2020 |
Glycerophosphodiesterase 3 (GDE3) is a lysophosphatidylinositol-specific ectophospholipase C acting as an endocannabinoid signaling switch Article de journal Dans: Journal of Biological Chemistry, vol. 295, no. 46, p. 15767–15781, 2020, ISSN: 1083351X. |
2019 |
The Actin-Based Motor Myosin Vb Is Crucial to Maintain Epidermal Barrier Integrity. Article de journal Dans: The Journal of investigative dermatology, vol. 139, no. 7, p. 1430–1438, 2019, ISSN: 1523-1747 (Electronic). |
2018 |
The beta and alpha2delta auxiliary subunits of voltage-gated calcium channel 1 (Cav1) are required for TH2 lymphocyte function and acute allergic airway inflammation Article de journal Dans: J Allergy Clin Immunol, vol. 142, no. 3, p. 892-903, 2018, ISSN: 1097-6825 (Electronic) 0091-6749 (Linking). |
TLR7 escapes X chromosome inactivation in immune cells Article de journal Dans: Sci Immunol, vol. 3, no. 19, 2018, ISSN: 2470-9468 (Electronic) 2470-9468 (Linking), (In the top 5% of all research outputs scored by Altmetric. http://www.altmetric.com/details/32261033). |
Switching between individual and collective motility in B lymphocytes is controlled by cell-matrix adhesion and inter-cellular interactions Article de journal Dans: Scientific Reports, vol. 8, no. 1, p. 5800, 2018, ISSN: 2045-2322. |
The Wiskott-Aldrich Syndrome Protein Contributes to the Assembly of the LFA-1 Nanocluster Belt at the Lytic Synapse Article de journal Dans: Cell Rep, vol. 22, no. 4, p. 979-991, 2018, ISSN: 2211-1247 (Electronic). |
Vectorial Release of Hepatitis E Virus in Polarized Human Hepatocytes Article de journal Dans: J Virol, 2018, ISSN: 1098-5514 (Electronic) 0022-538X (Linking). |
2016 |
CD8 T cell-mediated killing of orexinergic neurons induces a narcolepsy-like phenotype in mice Article de journal Dans: Proc Natl Acad Sci U S A, vol. 113, no. 39, p. 10956-61, 2016, ISSN: 1091-6490 (Electronic) 0027-8424 (Linking). |
2015 |
Intravacuolar Membranes Regulate CD8 T Cell Recognition of Membrane-Bound Toxoplasma gondii Protective Antigen Article de journal Dans: Cell Rep, 2015, (Nov 23. pii: S2211-1247(15)01288-7. doi: 10.1016/j.celrep.2015.11.001.). |
Alumni
- Josselin Ragu, Stagiaire M2 (2025)
- Lucie Demeersseman, CDD Inserm (2021)
- Danielle Daviaud, IE Inserm (2017-2020)
- Astrid Canivet, IE Inserm (2009-2020)
- Raïssa Houmadi, Doctorat en co-encadrement (2012-2017)
- Magda Rodrigues, IE Inserm (2008-2016)
- Daniel Sapede, CDD Inserm (2009-2010)
- Sabina Mueller, IE Inserm (2001-2005)
Contact & réservation
Le plateau technique est accessible en libre service après une formation obligatoire, et sur réservation (planning électronique). Une validation doit être demandée sur le site de Toulouse Réseau Imagerie pour chaque utilisateur.
Le plateau d’imagerie cellulaire d’Infinity est localisé à Toulouse sur le site de l’hôpital Purpan, au deuxième étage du batiment F, Pavillon Lefebvre, CHU Purpan.
La garantie d’un réseau de compétences et d’une qualité de services
Membre de TRI-GENOTOUL (Toulouse Réseau Imagerie) et de France BioImaging (FBI) – ISO 9001:2008 depuis janvier 2010 et NF X50-900 depuis février 2014.

Membre du RTMFM – Microscopie Photonique de Fluorescence Multidimensionnelle.

Membre du GDR CNRS-ImaBio.






